在现代生命科学研究中,如何获取更清晰的细胞和亚细胞结构图像以及如何对图像进行更精确地解读一直是一个核心主题。近日,浙江大学光电科学与工程学院生物医学光子学团队开发了一种结合了先进光学成像技术与智能计算的全新方法:结构驱动的定量(Architecture-driven quantitative, ADQ)成像框架。该框架将多模态成像技术与高灵敏度数据分析相结合,能够捕捉微管等细胞骨架的动态重塑过程。通过智能算法的支持,这一技术能够在不同成像模式间自动选择最佳方案,解决“如何看”的问题,确保研究人员不仅能“看得见”亚细胞动态,还能通过精细的数据解析“看得透”,挖掘出以往难以捕捉的生物现象,进而帮助研究人员找到数据中错失的“一个亿”信息。相关论文以Architecture-driven quantitative nanoscopy maps cytoskeleton remodeling为题在美国国家科学院院刊(PNAS)上发表。
2. 文章亮点
2.1. 如何获取图像:从多模态成像到结构驱动的智能计算成像
多模态成像,不只是将几种成像模式简单地叠加,而是智能整合不同模式的优势,实现在不同实验需求下灵活选择最优方案。根据这种思想,研究团队首先构建了一个集成四种不同超分辨成像模式的多模态系统,包括三维结构光照明显微(3D-SIM)、二维结构光照明显微(2D-SIM)、全内反射荧光显微(TIRF-SIM)以及多角度干涉显微(MAIM)。四种成像模式分别适合不同的应用场景:比如3D-SIM适合更厚、更立体的样本,但成像速度较慢;而TIRF-SIM则在处理细胞表面等浅层结构时更具优势,但成像深度有限。
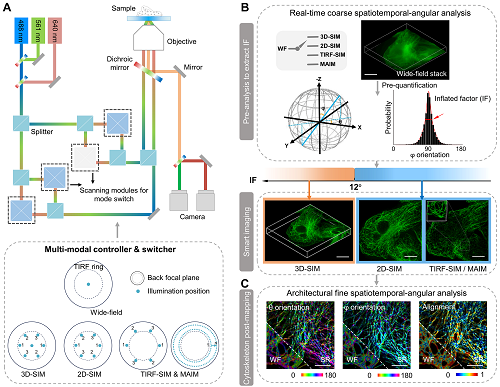
图1. 使用ADQ智能框架自动选择合适的成像模式。
更令人振奋的是,该系统并非仅仅依赖人为选择成像模式,而是通过智能算法,即ADQ框架,自动评估微管等细胞骨架的结构,决定最合适的成像模式。这一框架通过提取微管的三维角度信息,并结合计算出的膨胀因子(Inflated Factor, IF),可以在微秒级时间内为研究人员提供最优成像模式的选择依据。智能成像系统的核心在于,它在解决“看得见”问题之前,首先优化了“如何看”的问题。以往研究中,研究人员常面临成像模式的选择困境:一些成像模式虽然分辨率高,但图像获取速度慢,容易产生光毒性;而快速成像则常常牺牲了图像质量。ADQ框架通过其智能决策机制,不仅能够平衡分辨率与光毒性之间的矛盾,还能根据研究对象的不同需求,选择最优的模式组合。
2.2. 如何分析数据:高灵敏度精细定量解析亚细胞动态
获取高质量的图像只是生物医学成像的第一步,而对这些海量图像数据的深度分析,同样是揭示细胞微观行为的关键。ADQ框架不仅仅是一个智能成像工具,它的另一项创新之处在于对于亚细胞尺度数据的精确解析。通过该框架,研究人员能够对微管等纤维状结构进行体素级别的三维方向提取,并借助“有序度”(Order Index, OI)算法,揭示组织的重塑规律。与传统的分析方法相比,OI算法提供了更高的灵敏度和更精细的解析能力,可以检测出细胞骨架微小的动态变化。
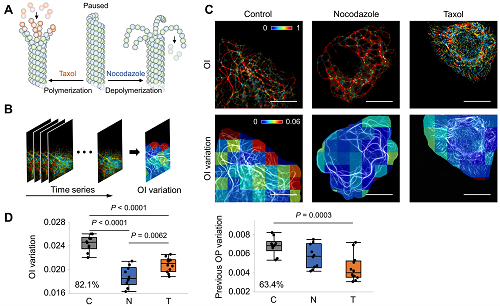
图2. ADQ精细揭示不同药物对微管稳定性影响。
这种高灵敏度的精细分析在亚细胞动态的研究中发挥了至关重要的作用。以细胞微管为例,细胞迁移、溶酶体运输和药物诱导的骨架重塑等过程,都涉及微管的复杂重组。传统的分析方法往往难以捕捉这些过程中的细微变化,而ADQ框架通过OI算法和时间特征的结合,能够对这些亚细胞动态进行逐帧跟踪,生成“微管重塑热图”(Microtubule remodeling map, MRM),清晰展示出不同区域的微管重塑水平及其方向变化。例如,本文研究了不同药物对微管稳定性影响的细微差异,使得研究人员能够深入探讨药物对细胞骨架的调控机制。这种数据解析能力对于未来的药物开发和生物医学应用而言无疑具有重要潜力。因此,ADQ框架通过成像与数据分析技术的结合,帮助生物医学研究从“看得见”向“看得透”迈进。通过对数据的精准定量解析,科学家不仅可以观察细胞的行为,还能更深入地理解这些行为背后的驱动机制。
2.3. 如何挖掘现象:从细胞迁移过程中的骨架重塑说起
在生物医学研究中,光学成像和数据分析只是揭开生命动态奥秘的开始,要深入挖掘复杂的生物现象,还需要进一步理解这些动态背后的机制。作为其中一个典型例子:细胞迁移在生命体发育、伤口愈合和免疫反应等过程中起着关键作用,其背后的生物学现象尤其值得关注。细胞骨架在迁移过程中发生的复杂排列和结构重组,与细胞前进的方向与方式密切相关。研究团队通过开发的ADQ框架,重点研究了两种不同的迁移模式:个体细胞的定向迁移与细胞互作引发的迁移,并揭示了这两种迁移模式下微管重塑方式的差异。在定向迁移中,微管的重塑呈现出明显的前后极化特征——在细胞的前缘,微管活动最为活跃,表现为强烈的OI数值的时间波动,形成推动细胞前进的重要动力。而在细胞尾端,虽然微管的重塑较前缘缓慢,但仍表现出明显的结构性调整,用于保持细胞整体的平衡与稳定。相较之下,细胞互作引发的迁移展现出完全不同的重塑模式。在这类迁移中,微管的重塑活动集中在细胞接触点附近。文中通过观察树突状细胞与T细胞的相互作用,发现树突状细胞的微管网络在接触点周围经历了剧烈的重塑,显示出一种围绕接触点的极化重组。 此外,ADQ框架不仅揭示了现象背后的微观动态,还展现了细胞迁移活动如何在长时间尺度上进行调整和适应。
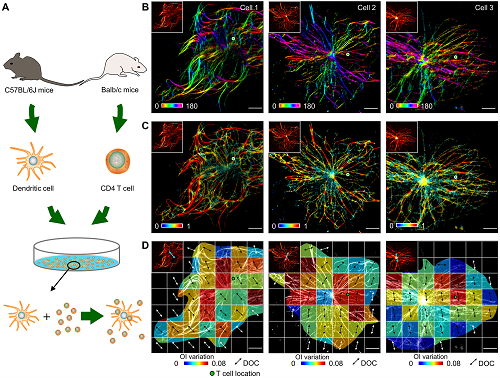
图3. ADQ框架研究了细胞互作引发的迁移。
研究人员发现,微管的重塑不仅仅是瞬时的反应,而是会随着细胞的运动轨迹持续调整。在长时程迁移中,微管的重塑方向甚至可以预测细胞的运动轨迹。这一发现表明,细胞骨架并非被动地响应外部环境,而是主动参与了细胞命运的决策过程。由此看出,ADQ框架为揭示细胞的动力学机制提供了一个新的平台,科学家可以更深层次地探讨细胞行为背后的内在机制,进而推动对癌症、免疫系统疾病等复杂病理过程的研究。
3. 总结与展望
通过将多模态成像与智能算法有机结合,研究团队提出的ADQ框架可以帮助科研人员选择“如何看”,完成“看得见”,并进一步实现“看得透”,不仅提供了探索细胞世界的强大工具,更能够揭示诸多生物现象背后的微观机制。无论是揭示个体细胞的定向迁移,还是解析免疫细胞的相互作用,ADQ框架展现了超越传统成像手段的强大能力。更重要的是,ADQ框架展现了面向未来生物医学研究的广阔前景。从癌症的侵袭转移,到神经退行性疾病的研究,ADQ框架让科学家们得以从微观层面更深入地了解疾病发生的机制。随着技术的不断成熟和应用扩展,这一创新方法将帮助科学家从海量数据中提炼出更多有价值的,“一个亿”的信息,为未来的药物研发和精准医疗提供强有力的支持。
4. 论文/作者信息
本研究论文中,浙江大学光电学院刘文杰博士、博士后孟佳、博士生钱书豪、医学院**计划研究员姚雨石为论文共同第一作者。光电学院**计划研究员刘智毅、丁志华教授、匡翠方教授、刘旭教授为该论文共同通讯作者。合作者包括光电学院韩于冰研究员、医学院附属邵逸夫医院特聘副研究员王涛等。本研究得到了国家自然科学基金资助。
论文链接:https://www.pnas.org/doi/10.1073/pnas.2410688121
 客服热线:
客服热线: