封面 |光子揭秘手性分子功能
Chinese Optics Letters 2024年第8期封面文章:
Qiheng Wei, Xueqian Wang, Hongrui Shan, Yi Lai, He Li, Hailang Dai, Xianfeng Chen, "Chirality discerning and monitoring in a metal cladding optofluidic chip," Chin. Opt. Lett. 22, 081202 (2024)
导读
手性是大自然的基本属性,大到宇宙宏观小到分子原子都存在手性。研究手性对于地球上的生命系统起着至关重要的作用。不同的手性对映体具有相同的物理性质,但在生命系统中经常表现出不同的生物学、药理学、毒理学性质和代谢活性。
在医药领域,目前临床上使用的至少一半以上的药物是手性药物,其中,手性分子的对映异构体在毒性、代谢机制和转运途径上显示出明显的差异。通常,仅一种对映异构体具有所需的药物活性,而另一种对映异构体则没有治疗作用,甚至可能引起严重的副作用。在食品科学领域,手性分子对映异构体的检测可以作为分析食品质量的指标,以及食用物质的感官特性也与立体化学有关,这是因为嗅觉和味觉受体是手性的。在农药领域,手性农药单一异构体的使用可降低农药的使用量,达到提高药效和降低农药对生物潜在毒性的目的。因此,手性分子研究的一个重要方面是用于对映异构体识别的高选择性、高灵敏度传感器的研究和开发,这一研究在生命、环境和材料领域具有非常重要的意义。

图1.手性分子识别的方法主要有对映选择性色谱法的仪器和光谱法仪器。
研究背景
现今,对于手性识别的方法主要有两大类:其一,对映选择性色谱法。该方法的工作机理是:手性溶质与吸附或固定在固定相表面上的手性选择剂相结合,瞬时形成非对映异构体复合物。这类结合方式是由各种疏水分子的静电相互作用引起和介导的,包括:高效液相色谱(HPLC、气相色谱(GC)、超临界流体色谱(SFC)、薄层色谱(TLC)以及毛细管电泳(CE)等。然而,这些方法由于需要复杂的仪器、专业的操作人员、繁琐的手性色谱柱制备、耗时的操作程序和较低的灵敏度等各类因素,限制了其对低浓度手性分子进行高通量分析的应用。
其二,光谱法。光谱法不像色谱法可以对对映异构体进行拆分,而是一种常用的对手性分子进行表征的方法。该方法的工作原理是基于手性分子与手性选择剂之间形成不同的非对映异构体,或者通过手性分子与手性选择剂之间吸附作用的差异来考察手性选择剂和手性底物的混合溶液在光谱上的细微变化。包括:紫外-可见光谱(UV-Vis)、质谱(MS)、红外光谱(IR)、核磁共振(NMR)及圆二色光谱法(CD)。
虽然色谱法和光谱法已经在手性分子识别和拆分上得到了广泛的应用,但如图1所示,由于这些方法通常需要昂贵的设备以及复杂的样品处理,效率比较低且难以实现实时在线检测,并且都是依赖于手性选择剂的使用才可以分析。因此,实现一种操作简单,可实时检测,并且无需标记的低溶度手性分子识别的方法被研究人员广泛关注。
为解决上述问题,上海交通大学陈险峰教授和戴海浪副研究员团队,利用双面金属光流芯片可对手性分子具有高灵敏检测的特性,并通过理论分析和细胞动物实验验证了利用双面金属光流芯片实现高灵敏实时监测手性药物分子在各器官脏器的浓度、代谢差异等可行性,因此,该工作为手性药物研究提供了强有力的全新工具。相关成果发表在Chinese Optics Letters 2024年第22卷第8期,并被选为封面文章。
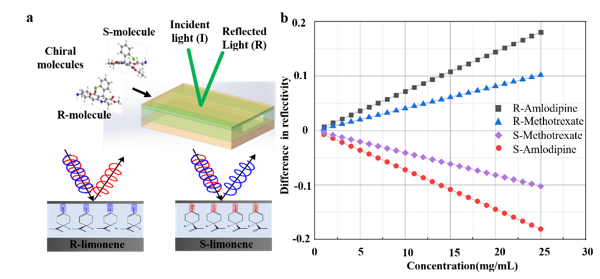
图2. 结构理论分析图。一束圆偏振光照射在双面金属光流芯片上表面耦合进入波导芯片内在横向上分离成两束光分别为左旋圆偏振光和右旋圆偏振光,由于手性分子及对映体对左/右旋偏振光的吸收存在差异,因此在反射方向上检测两束左/右旋偏振光的差异就可以检测出手性分子及对映体对的浓度及变化
研究成果
双面金属光流芯片对于入射光的自由空间耦合原理,其本质上是由入射光作用到芯片的薄银膜耦合层时,所激发的倏逝场和导波层内的本征模式发生共振,从而被耦合到芯片的导波层内。而芯片的本征模式和其导波层的厚度、介电系数关系紧密。因此,改变导波层的介电系数可以使得芯片的本征模式和入射光的共振条件发生偏移,其全光反射谱发生偏移,使得所探测到的反射光的强度和相位发生变化。同时,由于手性介质对于左/右旋圆偏振光的介电系数不同(折射率差异对应实部不同、吸收系数差异对应虚部不同),使得由手性介质作为导波层的芯片的对左/右旋圆偏振光的反射率存在差异,反射率的差值正比于手性介质的浓度,正负号与手性介质的左右手性对应。基于此,我们设计了一种基于双面金属光流芯片的手性检测方式,该方法能够实现快速、灵敏的手性检测,并且我们在细胞实验和动物实验中对该方法进行了验证。
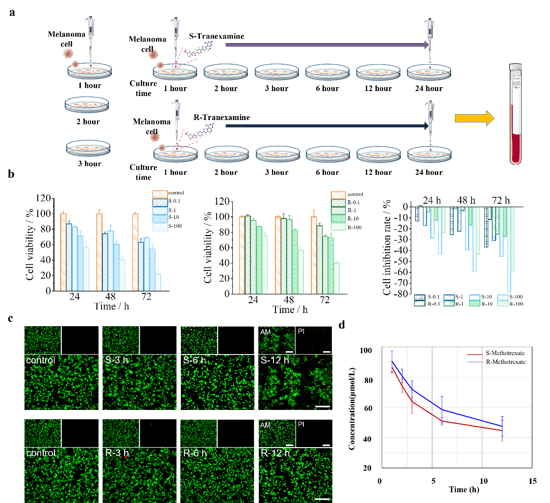
图3. 基于双面金属光流芯片的手性检测方法能够对细胞实验中手性药物浓度的变化进行测量
在细胞实验中,设计了细胞实验来探究甲氨蝶呤(MTX)抑制肿瘤细胞生长过程中,培养基内药物浓度的变化,以此来验证基于双面金属光流芯片的手性检测方法。随着时间的推移,培养基中的MTX药物浓度逐渐下降,表明此时MTX药物逐渐进入黑色素瘤细胞(B16细胞)并发挥作用,同时药物浓度变化的速度逐渐放缓。刚添加时的药物浓度变化趋势最陡,表明此时B16细胞对MTX的吸收速度快。
实验结果表明,随着时间推移,B16细胞内的MTX逐渐饱和,以及部分B16细胞在MTX作用下失活,使得B16细胞对MTX的吸收速度下降。并且经过长时间的共同培养后,培养基内的药物浓度变化曲线逐渐接近水平,意味着此时培养基内的B16细胞对MTX的吸收逐渐停止,表明大量B16细胞发生失活。
此外,对比MTX的两种对映体药物浓度随着时间的变化可以发现,S- MTX的药物浓度曲线下降得更快,其能够以更快的速度进入B16细胞内,在3 h到6 h这段时期内,两者的药物浓度差距最大。而当经过长时间的培养后,两者药物浓度的差距逐渐变小。这些实验结果和前面进行的细胞存活率研究、细胞活死染色成像、细胞形态学变化研究的结果是一致的,表明所提出的基于双面金属光流芯片的手性检测方法能够对细胞实验中手性药物浓度的变化进行测量。
在动物实验中,我们在大鼠进行了体内实验。在大鼠体内构建高血压模型,然后通过尾静脉注射S-/R- ADP,在不同时间测量大鼠的各项生命体征,通过眼眦取血,检测血液中药物浓度的变化来验证基于双面金属光流芯片的手性检测方法。
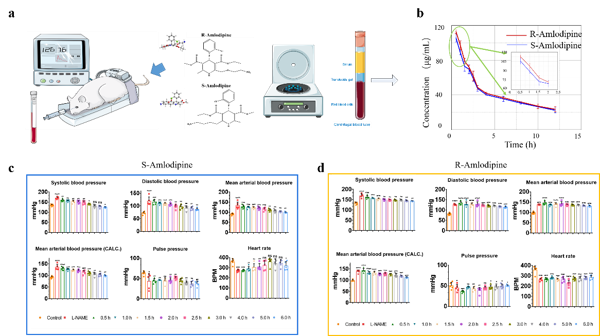
图4. 小鼠动物实验过程及R-/S- ADP对高血压模型的影响
通过双面金属光流芯片实时监测,S型氨氯地平(S-ADP)和R型氨氯地平(R-ADP)对于大鼠体内高血压模型的效果区别明显,在S-ADP作用下,大鼠的高血压被抑制,其各向生理指标逐渐趋于正常大鼠。而在R-ADP作用下,大鼠的血压仍然维持一个较高的水平,表明R-ADP对大鼠高血压的抑制效果差。随着大鼠体内代谢的进行,两种药物的浓度均持续降低,同时两种药物浓度的差距逐渐减小。这些结果和之前的实验结果是相吻合的,表明基于双面金属光流芯片的手性检测方法能够检测大鼠体内药物浓度随时间的变化。
未来展望
目前,通过体外和体内实验验证了该团队的芯片在手性药药效及代谢检测方面具有快速、高灵敏和准确性的优点。因此,利用光波导技术的手性分子的检测技术可以为生物制药及生命代谢过程提供一种新的可靠技术,也必将带来一定的社会价值和效益。
 客服热线:
客服热线: