通过光遗传学和新的医疗设备,听觉神经的光学刺激可以改善目前的听力恢复技术,提供更好的语音识别和音乐感知。
超过5%的世界人口(包括4.32亿成年人和3400万儿童),患有致残性听力障碍,这是最常见的感官缺陷之一。如果不加以治疗,听力损伤会影响一个人的沟通能力,据分析因此每年造成的全球损失约7500亿美元。听力障碍会减少就业机会,导致社会孤立、增加抑郁风险和认知能力下降的风险。
大多数听力损伤是所谓的感音神经性听力损害。耳蜗是内耳的螺旋状结构,它通过中耳接收声音振动,并通过专门的“毛细胞”将其转化为大脑的电信号。除了遗传因素外,感官神经性听力障碍通常是由于噪音、药物、缺血、创伤或感染而对耳蜗造成的损害,这通常会导致感官毛细胞和听觉神经元的退化。
在可预见的未来,根据听力损伤的严重程度和原因,助听器和电子耳蜗植入仍将是大多数人听力康复的关键手段。助听器主要用于治疗中度听力障碍,当语音识别能力变得有限时。这些设备分析周围的声音信号,并通过音箱或骨耦合为耳朵提供一个放大的、经过预处理的信号。
更严重的听力损害或耳聋,助听器无法解决人工耳蜗植入的问题。这些手术植入的装置用电刺激螺旋神经节神经元(SGNs),从而产生听觉神经的神经细胞。电子人工耳蜗可能是目前最成功的神经假体,迄今为止,全世界共植入70多万个人工耳蜗。然而,植入人工耳蜗的听力远未恢复正常。虽然可以在安静的环境中解析语音,但在日常生活的嘈杂环境中,用户很难解析语音信号,而且追踪旋律和欣赏音乐也很有挑战性。这通常归因于从植入体中每个电极接触到的电流的广泛传播,这限制了声音编码的频率分辨率。
光学信号而非电子信号,可能带来的空间限制和频率分辨率的改善,可能提供了会更好的方法。来自德国初创公司OptoGenTech GmbH 的研究人员们结合光遗传学和专门的光学耳蜗植入的听力恢复方法,他们的实验室最近实现了这项技术的从原理证明以及初步的临床转化。
目前植入体的缺点
为了理解电子耳蜗植入的一些问题,可以把耳蜗想象成一个圆形的楼梯,每一步对应着一个声波频率。复杂的耳蜗微结构可以让人类沿着耳蜗的所谓频率拓扑轴辨别大约2000步(频率)。每个SGN由一个内部毛细胞刺激,而最能刺激神经元的声音频率取决于毛细胞的“位置编码”,即它在频率拓扑轴上的位置。 由于电极接触电流的扩散,传统的耳蜗植入物对这个地方编码的利用很差,因此其声音编码的频率分辨率很低。激活该设备的12到24个电极触点中的一个会触发多个步骤,也就是说,一次会触发许多不同的频率。此外,相邻电极接触会刺激重叠的神经元群,进一步限制了频率分辨率。
植入式人工耳蜗对SGN的直接刺激与通过耳蜗毛细胞的刺激不同,有一个额外的缺点:生理和感知反应变化的动态刺激范围比正常听力小得多。普通生理声音编码的广泛动态范围可追溯到多种机制:基底膜(Corti器官中携带感官毛细胞的结构)对弱振动的放大和强振动的衰减,毛细胞、突触和神经元的适应,以及通过SGN强度编码对动态范围进行“平铺”。神经元通过感知刺激速率的变化(可归因于响度)和在受刺激频率点附近招募其他神经元来编码增加的体积。 电刺激的宽脉位扩散意味着电子耳蜗植入并不利用这些机制。因此,虽然该设备在实验室中可以实现良好的强度识别,但其动态范围有限,在现实生活的嘈杂背景下很难理解语音。虽然正在努力改善人工耳蜗的性能,例如通过电流转向,减少电兴奋扩散效果似乎相当有限。
感官缺陷的光遗传学治疗
由于光比电刺激具有更好的空间限制,听觉神经的光刺激可以很好地克服电耳蜗的性能瓶颈。研究人员们的工作表明,未来的植入式光学耳蜗可以增加人工声音编码的光谱选择性,从而可能改善背景噪声的语音识别,以及对旋律和音乐的处理。
目前正在研究两个关于听觉神经的光学刺激的概念。美国西北大学的研究人员的工作旨在利用红外直接神经刺激,被认为是通过光热效应激活神经元。另一种机制,是德国哥廷根的实验室首创的听觉神经的光遗传刺激。这种方法包括通过基因修饰听神经细胞来表达光门控离子通道,从而实现听神经光敏。
在过去20年里,光遗传学结合遗传学和光刺激技术来控制细胞,成为生物实验室的一项颠覆性技术,临床应用直到现在才开始出现。光遗传学在解决人类听力障碍方面的潜力可以从该技术最近的首次临床应用中推断出来,该技术处理了另一种感知——视觉方面的问题。 与耳朵不同,眼睛目前没有类似于人工耳蜗的感知恢复手段。通常情况下,视网膜植入物无法使视力恢复到法定失明标准之上,因此不再生产。然而,眼科退变性疾病视力恢复的迫切需求仍未得到满足,而病毒载体基因治疗技术的发展,加上光刺激机制,推动了眼科光遗传治疗的发展。
这些工作始于一项由Allergan公司进行的基因治疗安全性试验,该试验使用腺相关病毒(AAV)作为载体,在视网膜输出神经元中插入表达光敏蛋白通道视紫红质的基因。随后,最近开始了由GenSight Biologics牵头的PIONEER试验,该试验提供了一份表明疗效的初步报告。PIONEER试验采用了AAV介导的基因疗法,在视网膜输出神经元中表达红光激活通道视紫红质,并辅以光放大护目镜,以解决一种特殊的、罕见的遗传性失明——视网膜色素变性(见 OPN, www.osa-opn.org/news/sight-optogen)。
从视网膜到耳蜗
与视力一样听觉恢复的光遗传学方法需要多学科的合作,因为它们结合了基因治疗和医疗设备:植入式光学耳蜗。此外,耳蜗和视网膜作为基因治疗的靶点是具有优势的,它们两者都只需要很小的AAV剂量,而且都是“免疫特权”,占据着身体免疫反应被局部抑制的微环境。然而,由于神经元的细胞体或躯体“隐藏”在耳蜗的骨核心中,SGN的光遗传学操作面临一些特定的挑战。
从某种程度上说,光学人工耳蜗的发展是建立在通过电子植入改善听力的长期经验之上的。音频处理、经颅信号和供电技术是植入式电子耳蜗的先驱者,同样,在耳蜗充满液体的自然腔内植入灵活的、封装良好的刺激性植入物,也同样适用于光学耳蜗。
然而,切换到光刺激确实带来了优势和挑战。但将植入式光学耳蜗应用到临床需要证明医疗设备本身和所需的基因治疗的可行性、安全性和有效性。光学声音编码比电子声音编码的优越性必须得到证明,因为更复杂的光学人工耳蜗的临床应用只有在它被证明是对听力恢复有重大改善的情况下才是合理的。
早期的进步
目前,理论证明研究和对啮齿类动物的进一步研究已经朝着这些目标取得了相当大的进展。其中一个关键步骤是证明了单剂量病毒载体在小鼠、大鼠和沙鼠的SGN中安全稳定地表达了AAV介导的光敏通道视紫红质蛋白。在这些动物的基因改变的听觉神经上的光遗传刺激已经被证明激活了听觉通路到皮层,并导致与听觉感知一致的行为。 为了进一步发展,研究人员们开发了多通道植入式光学耳蜗,使用微尺度的蓝光发光二极管(µLED)来刺激光基因修饰的神经元。一个低重量(小于15克)、的电池驱动的无线可控系统从外部捕获和处理声音,并无线操作植入的µLED。实验表明,该系统恢复了人类耳聋的啮齿动物模型的听力。
但是,与人工耳蜗相比,该系统的性能如何呢?为了找到答案,研究人员们将植入式光学耳蜗与电子耳蜗进行了对比,该系统仅在驱动电源上有所不同,并采用了临床的电极阵列进行刺激。计算机模拟和活体动物实验都表明,光遗传刺激的光谱选择性接近正常听力,并显著超过最先进的电子耳蜗植入。实验结果证实了近生理光谱分辨率的潜在实现,该分辨率可通过基于电子显微镜的多通道光学耳蜗植入技术实现。
此外,值得注意的是,迄今为止测试的光学耳蜗植入装置尚未对空间选择性刺激进行优化。研究人员们测试的系统使用了4个50 μ m大小的μLED块或是单个200×250 μ m的μLED块,这些朗伯体发射的光束没有进行任何光学整形。确定最大可达到的光谱选择性将需要未来使用窄高斯光束分布发射器的实验。 为此,研究人员们最近开发了结合激光二极管和聚合物波导的实验性红光光学耳蜗植入物。红光刺激对于最近发现的通道视紫红质成为了可能,它不仅有更好的光谱选择性(更少的散射),而且降低了潜在的光毒性对神经细胞的影响。
时间保真度:速度的需要
然而,红灯激活的通道视紫红质Chrimson在室温下关闭光照后的时间常数是25毫秒,这是研究人员们在发展光遗传听力恢复方面必须解决的一个关键问题。SGN每秒发射数百个尖峰,精确到毫秒级,允许尖峰定时、真实地报告激励的时间精细结构。这增加了光遗传听力恢复的风险,也就是说光学耳蜗植入的高光谱分辨率是用电子耳蜗植入的SGN刺激的极佳时间保真度换取的。
因此,研究人员们设计并应用了超快失活通道视紫红质,以提高光发生声音编码的时间保真度。对于Chrimson来说,目前已经创造出了快速(在体温下3毫秒)到超快(在体温下1毫秒)失活的变异体。这些Chrimson变体应该能够可靠地驱动SGN,并具有良好的时间精度,激励速率约为200 Hz。另一些通道视紫红质比如蓝光激活的Chronos,它在体温下的时间常数为0.7 ms,原则上可以提供更快的动力学。然而,通道开启时间越短,每光子吸收产生的电荷转移就越少,这就需要更大的功率预算。因此,光遗传听力恢复需要平衡时间保真度和编码功率预算。将激励率限制在200Hz似乎是合理的,这基于从实验获得的语音理解作为植入式电耳蜗的刺激率的函数。
除了固有的光谱分辨率和可比的时间保真度外,光学耳蜗植入物能否在单神经元水平上改善电子植入物的有限强度编码呢?最近的研究表明,光激励的动态范围为1-7 dB (mW),而电激励的动态范围为1-2 dB(电流)。由于这两种激励方式很难直接比较,未来在神经群体水平或行为上的实验将需要将光遗传激励与实际听觉进行比较。
临床试验
虽然光学人工耳蜗的早期进展令人鼓舞,但在第一次人体试验之前仍有很多工作要做,目前计划在2025年底前开始人体试验。由于该产品结合了基因治疗和医疗设备,这两者都需要进一步开发和测试,并且这种组合的安全性和有效性必须得到评估。
在基因治疗方面,继续的工作必须集中在设计最佳的基因结构,使听觉神经对光敏感,即在生理激发率和低光需求下,能够实现SGN的强大光遗传激活。此外,用于将这种光遗传密码转导到SGN的病毒载体必须经过优化,以安全、有效地传递其遗传有效载荷。AAV可能是首选的载体,因为它们能使外源蛋白长时间高水平表达。此外,AAV对靶细胞的不良反应风险小,已被用于各种基因治疗(包括视网膜功能障碍)的临床试验,并已成功用于聋哑动物模型的听觉功能恢复。植入足够的启动子并将病毒局部应用于骨化耳蜗将有助于限制向SGN的转导,从而排除听觉神经以外的视蛋白表达。在光遗传听力恢复的基因治疗部分成功实施后,需要评估慢性光照对脑内神经组织的影响。为了避免组织受热或光毒效应,需要确定光强的安全限制。这些考虑应该促进保护耳蜗结构和脱靶组织,以保证患者的安全。
对于医疗设备组件,虽然通信和处理器技术可以很容易地套用植入式电子耳蜗,但由于视蛋白动力学的时域限制,以及相对于电子设备的激励通道的增加,光学耳蜗可能需要新的编码策略。足够SGN激活的最小光脉冲持续时间和强度将取决于光发生工具的通道动力学。声音强度编码将需要在神经元的自然放电率下使用光诱发SGN激活的全部范围,直到达到上限,即放电饱和或实验对象的行为信号不适。单个脉冲的能量需要在其持续时间(需要被限制以允许高刺激率)和强度(受生物安全限制)之间进行平衡,还必须考虑到光学耳蜗的合理电池寿命。光学声音编码模式将需要映射到一组独立的光学刺激通道上,这些通道的数量要大于电子植入物编码光谱信息的数量。
目前,将光学耳蜗植入物从实验室转移到临床是研究人员们努力的目标。研究人员们相信,这项工作能为听力受损的患者提供更丰富、更自然的对话和音乐体验,是十分有意义的。
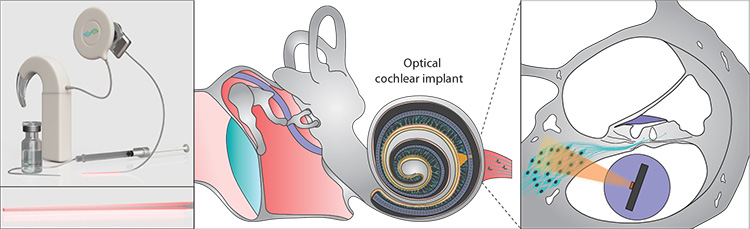
光遗传听力恢复系统(左)将使用外科手术植入的光学装置(中),类似于植入式电子耳蜗,对听觉神经元(右)进行光谱选择性光学刺激,这些神经元已经被转基因,表达光敏蛋白或通道视紫质。
 客服热线:
客服热线: