肿瘤抑制微环境以及免疫源性低下是限制免疫检查点阻断治疗在临床应用的关键问题。目前临床使用的免疫检查点抑制剂PD-L1抗体虽然对多种肿瘤显示出可喜的治疗效果,但仅对一少部分患者(10-30%)有效。其中一个重要的原因在于,具有免疫抑制的肿瘤微环境极大地限制了肿瘤浸润淋巴细胞的招募和浸润。因此,这种被认为是免疫抑制的“冷肿瘤”,对基于PD-L1免疫检查点阻断治疗的应答率较低。为解决这一问题,浙江大学平渊团队构建了具有深部组织穿透的超分子金纳米棒,通过光热基因技术来实现肿瘤细胞PD-L1基因的敲除,并通过所产生的局部微热诱导免疫原性细胞死亡,同时逆转免疫抑制的“冷肿瘤”微环境为免疫激活的“热肿瘤”微环境,以协同增强肿瘤免疫治疗。相关结果发表在Advanced Materials(DOI: 10.1002/adma.202006003)上。
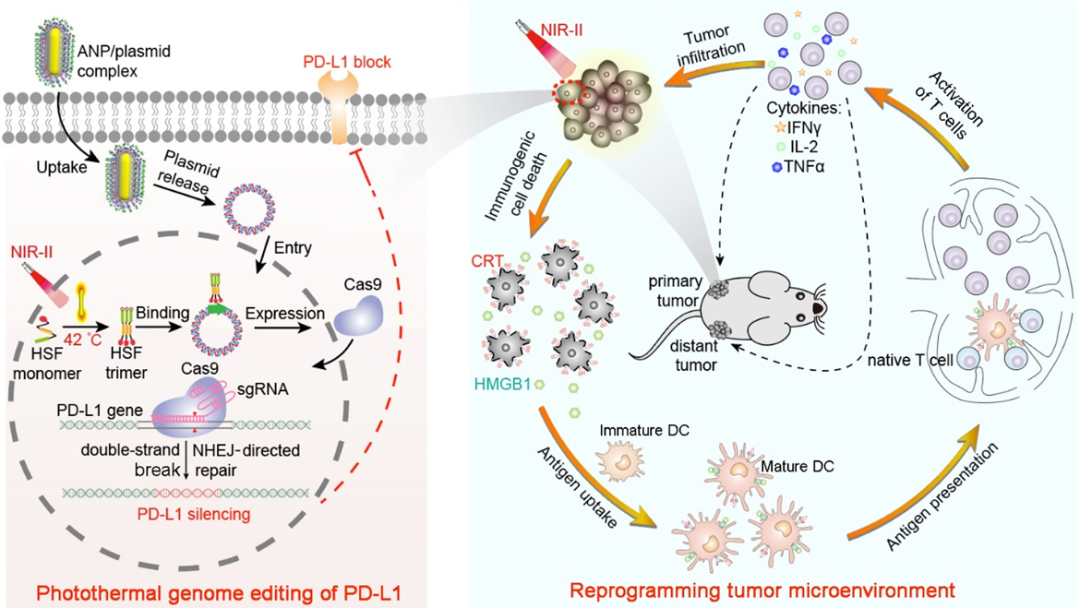
光热基因编辑技术是平渊团队提出的一种新型精准基因编辑策略,即通过光热转化来启动编码基因编辑内切酶热启动质粒的转录过程,从而实现基因编辑的时空特异性(Proc. Natl. Acad. Sci. USA, 2020, 117, 2395-2405)。在此工作基础上,研究人员通过超分子自组装,实现对阳离子金纳米棒的胍基化,以促进其肿瘤深部穿透的能力。由于超分子金纳米棒可吸收具有深部组织穿透的近红外II区光并将之转化为热能,因而可以激活肿瘤深部的热启动基因编辑质粒的转录过程,以实现基因编辑内切酶在深部肿瘤细胞中的表达。研究表明,超分子阳离子金纳米棒可高效递送编辑肿瘤PD-L1基因的热启动质粒至肿瘤深部,通过光热基因编辑敲除PD-L1基因以降低肿瘤细胞表面的PD-L1配体表达;同时利用局部微热产生的免疫原性细胞死亡效应诱导肿瘤抗原释放,促进树突状细胞分化及成熟,活化细胞毒性T淋巴细胞向肿瘤组织浸润,并有效攻击肿瘤细胞。因此,这种光热基因编辑肿瘤PD-L1基因的治疗方法,可有效地将肿瘤微环境状态从免疫抑制逆转为免疫激活,抑制了原发和转移性肿瘤的活性,延长了小鼠的存活期,并对复发性肿瘤表现出长期的免疫记忆效应。该研究通过光热基因编辑策略及其递送技术,可有效改善免疫抑制微环境,增强肿瘤免疫源性,为肿瘤免疫治疗提供了新思路和新方法。
上述研究工作得到了国家自然科学基金面上项目(82073779,81872807和81573003)、浙江省自然科学基金杰出青年项目(LR21H300002)、国家科技部重点研发计划(2018YFA0901800)、中央高效基本业务费专项基金(2018XZZX001-14)的支持。
 客服热线:
客服热线: