基于诊疗一体化理念,新兴发展的纳米诊疗系统将诊断和治疗功能有机结合,相对于单一的诊断或治疗手段具有明显优势。现有的纳米诊疗剂中,光诊疗剂以其特定选择性、较深穿透性、高效率和最小侵袭性而引起了人们的广泛关注。然而,现有纳米诊疗系统存在两个主要缺陷,一是无论是检测信号和治疗药物都处于“always-on”的固定结构模式,导致背景信号高,极大降低了检测的灵敏度;二是激发窗口主要位于可见光或近红外一区,穿透深度不够,与组织的相互作用相对较低,限制了其热敏效应。
近日,陆军军医大学第二附属医院张冬教授、刘云副教授课题组与厦门大学刘刚教授、西南石油大学刘一丁教授组成的研究团队,开发了一种基于二氧化硅包裹的自组装金纳米链(AuNCs@SiO2)可激活的NIR-II等离激元纳米诊疗系统,很好的解决了上述不足。该研究通过响应肿瘤微环境实现等离激元纳米粒子的结构演化来精确控制光学性质,因而对肿瘤可进行精准诊断和高效治疗。首先,其构建的等离激元纳米诊疗系统将柠檬酸根配体保护的金纳米粒进行一维链式组装,接着通过对其表面包裹二氧化硅以保持金纳米链的稳定性。在正常组织中,该自组装金纳米链不发生结构改变,呈现近红外二区光声、光热“OFF”状态;而当金纳米链进入恶性肿瘤组织,金纳米粒表面的柠檬酸根配体将与微环境中高表达的过氧化氢发生氧化还原反应,柠檬酸根被氧化分解,导致金纳米粒表面配体急剧减少而处于不稳定状态,进而促使相邻的金纳米粒在二氧化硅有限空间内进行融合。链结构的融合使整个链结构具有电子传导性,电场强度明显增强,使得表面等离激元共振消光峰发生红移,呈现近红外二区光声、光热“ON”状态。由于金纳米粒之间“热点”的存在和链结构电子传导性效应,光声增强效应显著,乳腺癌恶性肿瘤处光声信号明显增强,从而实现特异性诊断乳腺癌诊断以及光热治疗。该激活型策略实现原位、高灵敏检测肿瘤的同时能达到高效杀伤肿瘤的效果,显著提高存活率,为探索光学纳米工程在NIR-II窗口中实现智能、准确、无创治疗开辟一条新的途径。
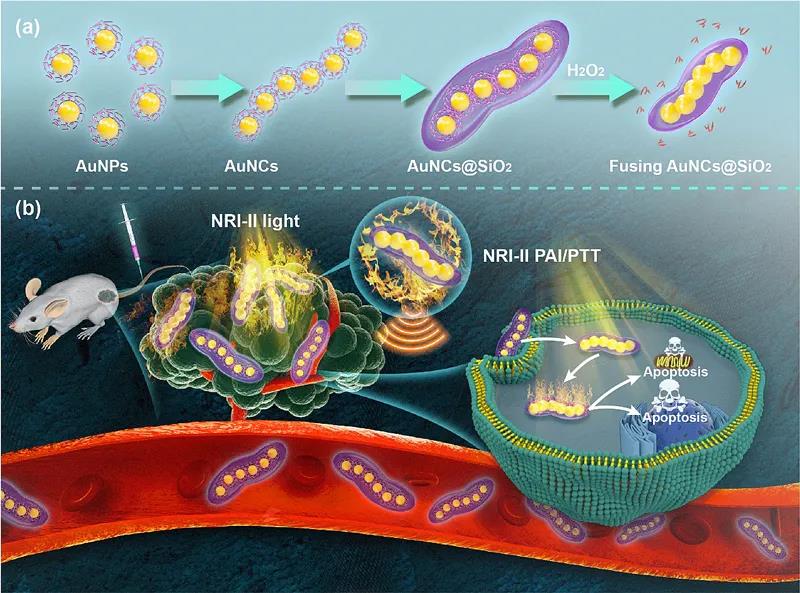
图1. 研究示意图: AuNCs@SiO2的合成过程和诊疗一体化应用示意图。
相关论文于近期发表在Advanced Materials 杂志。文章的第一作者是陆军军医大学第二附属医院周春宇副研究员以及张亮、孙涛。共同通讯作者为陆军军医大学刘云副教授、张冬教授、厦门大学刘刚教授和西南石油大学刘一丁教授,这项工作得到了国家自然科学基金、重庆市自然科学基金的资助。
原文(扫描或长按二维码,识别后直达原文页面):

Activatable NIR-II Plasmonic Nanotheranostics for Efficient Photoacoustic Imaging and Photothermal Cancer Therapy Chunyu Zhou, Liang Zhang, Tao Sun, Yang Zhang, Yiding Liu, Mingfu Gong, Zhongsheng Xu, Mengmeng Du, Yun Liu, Gang Liu, Dong Zhang Adv. Mater., 2020, DOI: 10.1002/adma.202006532
 客服热线:
客服热线:














