化疗被广泛应用于癌症治疗,由于脱靶效应导致的毒副作用以及可能引发的耐药性,疗效往往不尽人意。纳米生物材料的兴起为抗肿瘤药物靶向控释提供了新的可能。与此同时,利用肿瘤部位耐热性低于正常组织的特征,热疗的引入有望提高及巩固单一化疗的抗癌疗效。近年来,基于纳米材料的光热剂被广泛开发,其中利用近红外激光诱导的光热转化因其无损伤、高穿透性而备受关注。金纳米材料既可用于药物装载又可实现近红外辐照产热,且其制备反应体条件温和,易于功能化修饰,生物稳定性优良,是理想的纳米光热剂之一。
得益于其特有的光物理学性能,金纳米材料在表面增强拉曼光谱(Surface-enhanced Raman spectroscopy, SERS)成像领域有卓越的应用前景。拉曼图像的信号来源于拉曼探针分子振动光谱。在多刺的金纳米结构上,等离激元效应所产生的强烈电磁场可增强其表面拉曼散射,继而显著放大位于金表面的探针分子的光谱信号。有赖于外源性探针分子的“嵌入”,从而以高信噪比追踪金纳米材料在肿瘤部位的富集状态。此外,拉曼与光声成像的结合,突破传统光学成像在深度及分辨率方面的短板,实现特异灵敏的深度成像。
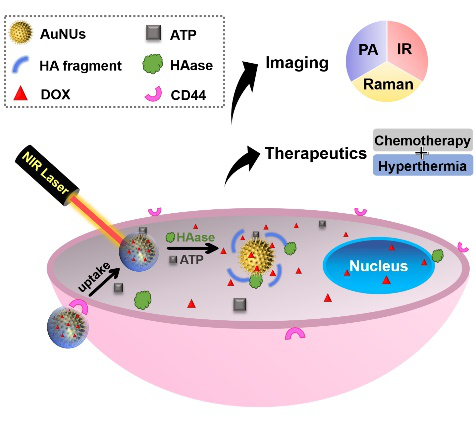
美国史蒂文斯理工学院Hongjun Wang课题组应用高分子胶束为软模版合成出一种新型金纳米海胆。功能化修饰的金纳米海胆可经π-π共轭作用高效装载化疗药物阿霉素(DOX)。拉曼探针4-MPBA通过Au-S键合在AuNUs表面,使其具备拉曼报告功能。同时,4-MPBA与多巴胺连接提供ATP响应性的硼酸酯键,而后透明质酸(HA)通过酰胺键包覆于表面。该纳米系统可对CD44高表达的肿瘤细胞进行主动靶向,并在肿瘤区域高表达的透明质酸酶(HAase)及ATP作用下触发药物释放。体内体外研究结果表明,AuNUs-HA@DOX纳米体系可用于光热联合化疗和光声-拉曼成像。相关论文在线发表在Advanced Therapeutics (DOI:10.1002/adtp.202000114)上。
 客服热线:
客服热线:














