光动力治疗已经广泛用于肿瘤治疗的临床研究。传统的光动力治疗是通过外在可见光进行特定的光敏剂激发,从而产生活性氧进而达到杀死癌细胞的效果。但是由于可见光穿透深度的局限性,更多可替代的激发光源被开发出来,比如近红外光,X射线,切伦科夫辐射。大多数核素可以产生带有蓝紫光的切伦科夫辐射,从而可以作为内置光源进行UV吸收的光敏剂的激发。但是切伦科夫辐射中较低的光子效率限制了其肿瘤治疗效果。
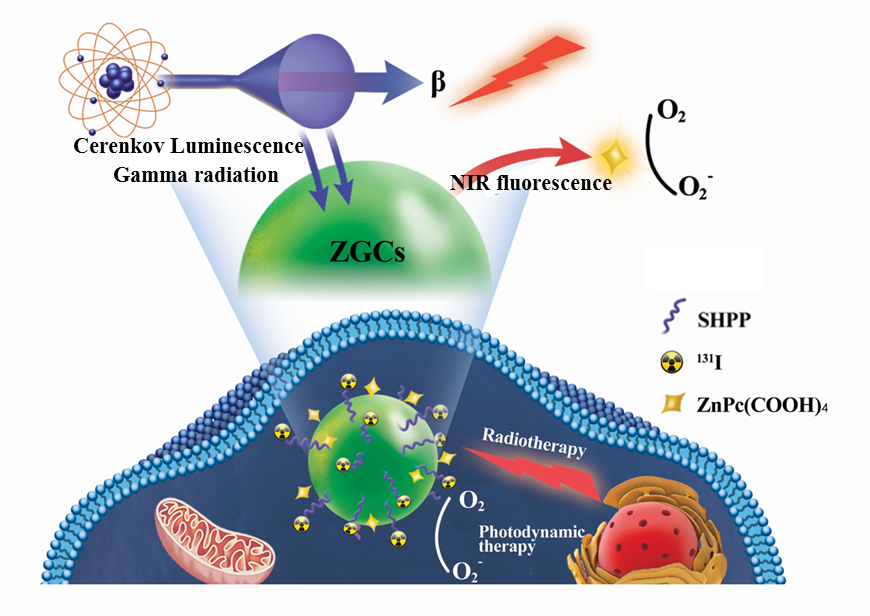
中国药科大学药学院孙晓莲教授和厦门大学中山医院苏新辉教授针对这一局限性提出了碘131标记的长余辉纳米体系用于辐射激发的光动力和放疗的肿瘤联合治疗。课题组前期研究发现短半衰期的放射性药物18FDG可以作为内置光源激发ZnGa2O4:Cr3+(ZGCs)长余辉纳米材料产生近红外光余辉光(Small 2020, 2001494)。本研究利用放射性核素碘131激发ZGCs产生长时间的荧光持续激发近红外光敏剂(四羧酸酞菁锌),从而产生光动力治疗效果。同时纳米体系可以高效地递送治疗性核素-碘131到肿瘤细胞达到放疗杀伤效果。这种基于放射性纳米体系的联合治疗在避免使用外在激发光源的前提下,展现出很好的肿瘤抑制效果。研究者相信碘131标记的长余辉纳米体系可以提供一种对深层肿瘤治疗的更有效的方法。相关结果发表在Advanced Hearlthecare Materials(DOI: 10.1002/adhm.202000802)上。
 客服热线:
客服热线:














